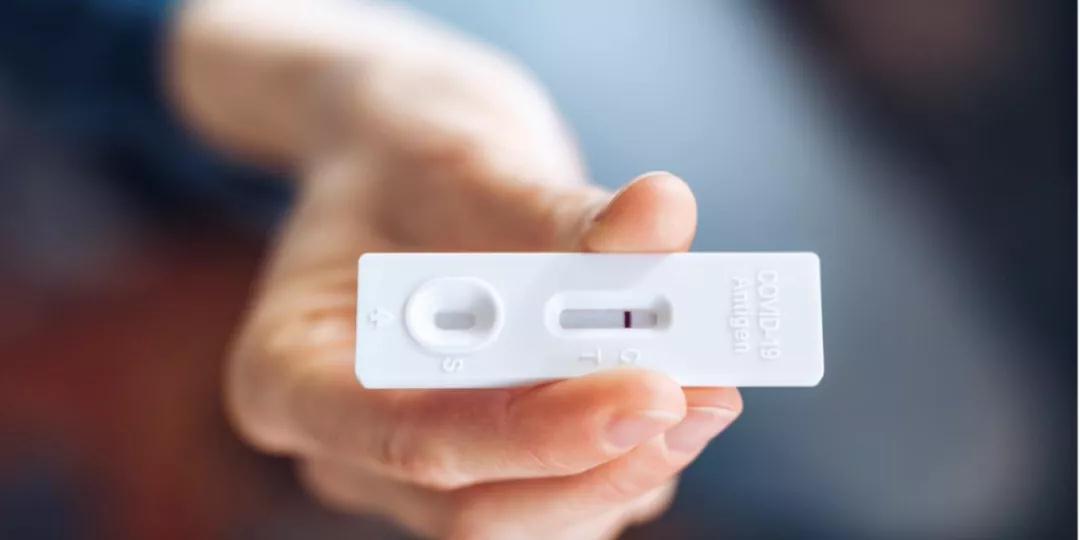
巴西国家卫生监督局(Anvisa)本周五(17日)批准了巴西首个新冠病毒自我测试产品。该产品被命名为 “新型冠状病毒抗原自我检测盒”,由巴西CPMH医疗、医院和牙科产品生产和销售公司生产。
被批准的产品使用非深层鼻拭子样本,15分钟后显示检测结果。国家卫生监督局对注册申请进行了16天的评估,其中包括申请单位为满足监管机构提出的技术要求对产品进行调整的4天时间。
到目前为止,卫监局已收到69份要求在巴西注册新冠自检产品的申请,其中10份已被拒绝,主要问题是提交文件不齐全以及研究内容不完整。
卫监局在发给媒体的说明中详细解释:“在批准注册前,卫监局对产品的一系列技术要求进行分析,其中包括对产品在使用方便性和风险管理方面的评估,这有助于使产品更适合非专业人士使用,使产品的使用更加安全。”
巴西药房和连锁药店协会(Abrafarma)主席巴雷托(Sérgio Mena Barreto)在接受EXAME的独家采访时透露,巴西的药店系统对开始销售新冠自检产品的期望很大。据预测,该产品将在3月初摆上药店货架。
但是,对于应该何时开始销售这种产品尚有一些未知因数等待解决。生产厂家的生产和供应能力是个大问题,产品到销售药店手中的价格也亟待确定。
巴雷托估计,从3月起,这类自我检测产品应该以50至60雷亚尔的平均价格向民众出售,低于目前在售产品的价格。
